Klor
| Klor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klor i en ampul. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikation | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC navn | klor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.029.053 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EF | 231-959-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E925 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Udseende | grønlig gul gas, skarp lugt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formel |
Cl 2 [isomerer] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar masse | 70,906 ± 0,004 g / mol Cl 100%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusion | -101 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kogning | −34,6 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Opløselighed |
14,6 g · l -1 i vand ved 0 ° C , 7,3 g · l -1 ved 20 ° C , 5,7 g · l -1 ved 30 ° C |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
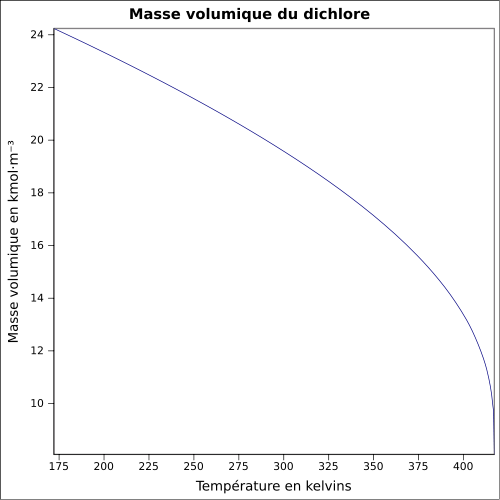
| Volumenmasse | 2,48 (tæthed i forhold til luft) ved 20 ° C , 6,864 atm : 1,4085 g · cm -3 (liq.) Ved -35 ° C , 0,9949 atm : 1,5649 g · cm - 3 (liq.) ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
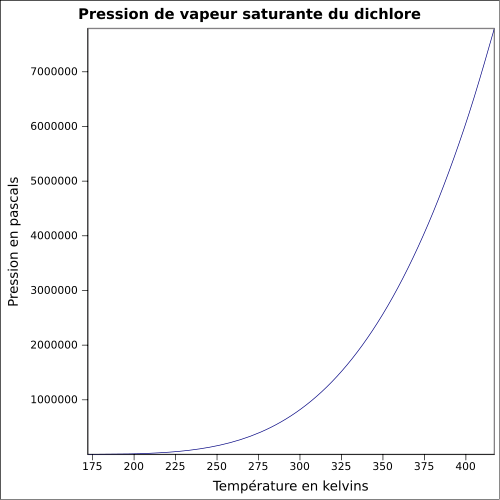
| Mættende damptryk |
6,776 bar ved 20 ° C 8,8 bar ved 30 ° C 14,3 bar ved 50 ° C ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt |
143,81 ° C 79,914 bar 0,57688 kg · s -1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point |
−100,98 ° C 0,01387 bar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lydens hastighed | 206 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokemi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° |
20,41 kJ · mol -1 ( 1 atm , -34,04 ° C ); 17,65 kJ · mol -1 ( 1 atm , 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C s |
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroniske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ioniseringsenergi | 11.480 ± 0,005 eV (gas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystallografi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pearson symbol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalklasse eller rumgruppe | Cmca ( nr . 64) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Strukturbericht | A14 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Typisk struktur | I 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forholdsregler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
    Fare H270, H315, H319, H331, H335, H400, H270 : Kan forårsage eller intensivere brand; oxidator H315 : Forårsager hudirritation H319 : Forårsager alvorlig øjenirritation H331 : Giftig ved indånding H335 : Kan irritere luftvejene H400 : Meget giftig for organismer , der lever i vand |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Komprimeret gas absolut damptryk ved 50 ° C = 750 kPa D1A : Meget giftigt materiale med alvorlige øjeblikkelige virkninger Transport af farligt gods: klasse 2.3 E : Ætsende materiale Transport af farligt gods: klasse 8 Offentliggørelse ved 1,0% i henhold til ingrediensbeskrivelsen liste Kommentarer: som præsenteret i fortolkningen af en sundhedspolitik i Canada behøver faresymbolet D1 (kraniet) ikke at blive vist på leverandørens etiket. Dog skal alle sundheds- og sikkerhedsrisici, der præsenteres af dette produkt, vises på etiketten og sikkerhedsdatabladet. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0 4 0 OKSE | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transportere | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
265 : giftig og oxiderende gas (fremmer brand) UN-nummer : 1017 : KLOR Klasse: 2.3 Klassificeringskode: 2TOC : Flydende gas, giftig, oxiderende, ætsende. Mærkater: 2.3 : Giftige gasser (svarer til de grupper, der er betegnet med et stort T, dvs. T, TF, TC, TO, TFC og TOC). 5.1 : Oxiderende stoffer 8 : Ætsende stoffer    |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indånding | kvælende lugt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Økotoksikologi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | 1 time: rotte 293 ppm mus 137 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lugtgrænse | lav: 0,02 ppm høj: 3,4 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enheder af SI og STP, medmindre andet er angivet. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Den chlor ( Cl 2 ) er en gas gulgrøn standardbetingelser ( Chloros betyder "grønne" i græsk ). Det er 2,5 gange tættere end luft . Det har en meget ubehagelig kvælende lugt og er ekstremt giftig, da den rekombineres med fugt i slimhinderne og lungerne for at danne syrer, der angriber vævene.
Klor blev opdaget af Carl Wilhelm Scheele i 1774 . Det blev brugt i WWI som bekæmpe gas , bertholite .
Klor er opløseligt i vand, der danner klorvand , men det er ikke opløseligt i saltvand.
Den molekyle chlor er dannet af to atomer af chlor .
Produktion
Kloren kan let produceres ved elektrolyse af en opløsning af natriumchlorid ( chloralkaliproces ):
2Na + + 2Cl - + 2H 2 O→ 2NaOH + Cl 2 + H 2Scheele syntetiseret det ved omsætning mangandioxid (MnO 2 ) med saltsyre (HCI).
Det kan også fremstilles i små mængder ved omsætning af saltsyre med kaliumpermanganat .
Hertil kommer, når en syre hældes i blegemiddel , en frigivelse af chlor observeres (men i nærvær af urinstof, til stede i urinen, den afgiver trichloramine (NCI 3 ), meget irriterende gas). Den klorometriske grad af en blegemiddelopløsning er volumenet af klor frigivet af en liter af denne opløsning (overskydende syre).
Cl - > + ClO - + 2H + → cl 2 + H 2 Obrug
Klor bruges som råmateriale til fremstilling af saltsyre ved reaktion mellem klor og dihydrogen .
Cl 2 + H 2 → 2HCIDet bruges også til at producere polyvinylchlorid (PVC).
Det anvendes til fremstilling af produkter med en carbon-klorbinding, såsom kølemidlet R12 dichlordifluormethan .
Det tjener også til at desinficere det drikkevand i stedet for blegemiddel .
Det blev brugt som en kampgas (fordi det irriterer de øvre luftveje og er giftigt) under første verdenskrig, hvor det efterlod fem tusind døde og femten tusind overlevende, og det efterlod ofrene med livslang konsekvens i de fleste tilfælde. .
Ejendomme
Klor har den egenskab at misfarve opløsningen af indigo og flere andre organiske stoffer. Farven på mange organiske farvestoffer kommer fra forskellene mellem de mange energiniveauer i deres konjugerede bindinger . Imidlertid oxiderer klor carbon-carbon dobbeltbindinger, som udgør konjugatbindingssystemerne.
Referencer
- CHLORINE , sikkerhedsark (er) i det internationale program om sikkerhed for kemiske stoffer , hørt den 9. maj 2009
- beregnet molekylmasse fra " Atomic vægte af elementerne 2007 " på www.chem.qmul.ac.uk .
- (da) Robert H. Perry og Donald W. Green , Perrys kemiske ingeniørhåndbog , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50
- (i) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 s. ( ISBN 978-1-4398-2077-3 ) , s. 14-40
- (i) David R. Lide, Gummibibelen , CRC Press,2009, 90 th ed. , 2804 s. , Indbundet ( ISBN 978-1-4200-9084-0 )
- (i) David R. Lide, Handbook of Chemistry and Physics , Boca Raton, CRC,2008, 89 th ed. , 2736 s. ( ISBN 978-1-4200-6679-1 ) , s. 10-205
- " The Molecular Iod (I2) Crystal Structure (A14) " , på http://cst-www.nrl.navy.mil/ (adgang til 17. december 2009 )
- Indeksnummer i tabel 3.1 i bilag VI til EF-forordning nr . 1272/2008 (16. december 2008)
- " Klor " i kemikaliedatabasen Reptox fra CSST (Quebec-organisation med ansvar for arbejdsmiljø), åbnet den 25. april 2009
- " Klor " på hazmap.nlm.nih.gov (adgang til 14. november 2009 )
- " File: Blegemiddel - Vandig opløsning af natriumhypochlorit " [PDF] , National Chamber of Bleach, maj 2010, s. 8 , § 7: Sikkerhed for mennesker, på eaudejavel.fr
- " Individuel eksponering og gruppeeksponering for klordampe ", belgisk giftcenter
- " Gas: 22. april 1915 i Ypres (Belgien) " , om Den store krig
- Kemi, obligatorisk S-terminal, 2002-program , Nathan, coll. "Sirius",2008, 351 s. ( ISBN 978-2-09-172496-6 ) , s. 248