Toluen
| Toluen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur og repræsentationer af toluen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikation | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC navn | toluen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymer |
methylbenzen |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.003.297 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EF | 203-625-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILE |
Cc1ccccc1 , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C7H8 / c1-7-5-3-2-4-6-7 / h2-6H, 1H3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Udseende | farveløs væske med en karakteristisk lugt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formel |
C 7 H 8 [isomerer] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar masse | 92,1384 ± 0,0062 g / mol C 91,25%, H 8,75%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolært øjeblik | 0,375 ± 0,010 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetisk modtagelighed | 66,1 × 10 −6 cm 3 mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molekylær diameter | 0,568 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusion | −95 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kogning | 110,58 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Opløselighed |
0,53 g l −1 i uendeligt vand i ethanol , acetone , hexan , dichlormethan |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Opløselighedsparameter δ | 18,2 MPa 1/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
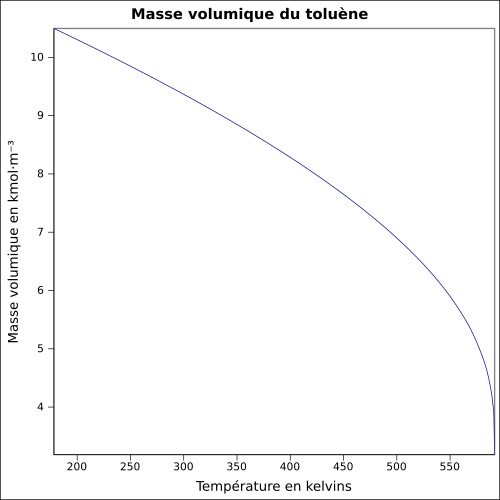
| Volumenmasse |
0,867 0 g cm −3
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Automatisk tænding temperatur | 480 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flammepunkt | 4 ° C (lukket kop) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eksplosionsgrænser i luft | 1,1–7,1 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
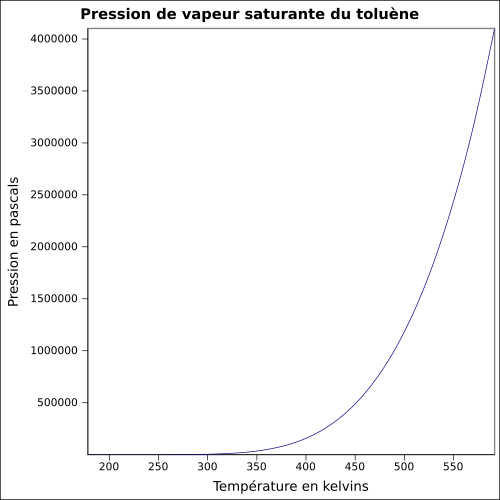
| Mættende damptryk |
29 hPa ( 20 ° C )
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dynamisk viskositet | 0,59 × 10 −3 Pa s ved 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kinematisk viskositet | 0,681 × 10 −6 m 2 s −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 318,65 ° C , 41,1 bar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokemi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C s |
ligning:
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| STK | 3 910,3 kJ mol −1 ( 25 ° C , væske) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brydningsindeks | 1.4941 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forholdsregler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Fare H225, H304, H315, H336, H361d, H373, H225 : Meget brandfarlig væske og damp H304 : Kan være dødelig ved indtagelse og ind i luftvejene H315 : Forårsager hudirritation H336 : Kan forårsage døsighed eller svimmelhed H361d : Mistænkes for at skade det ufødte barn . H373 : Mistænkt for fare for alvorlig organskade (angiv alle berørte organer, hvis kendt) efter gentagen eksponering eller langvarig eksponering (angiv eksponeringsvej, hvis det er endeligt bevist, at ingen anden eksponeringsvej fører til den samme fare) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D2A, D2B, B2 : Brandfarlig flydende flammepunkt = 4,4 ° C lukket kop Setaflash-metode D2A : Meget giftigt materiale, der forårsager andre toksiske virkninger embryotoksicitet hos dyr D2B : Giftigt materiale, der har andre toksiske virkninger Hudirritation hos dyren Oplysning ved 0,1% ifølge klassificeringskriterier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 2 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transportere | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1294 : TOLUENE |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IARC- klassificering | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe 3: Kan ikke klassificeres som kræftfremkaldende for mennesker | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indånding | Kvalme, opkastning | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Økotoksikologi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 2,69 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ADI | 0,22 mg / kg lgv / dag | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lugtgrænse | lav: 0,16 ppm høj: 37 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enheder af SI og STP, medmindre andet er angivet. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Den toluen , også kendt som methylbenzen eller phenylmethan er et aromatisk carbonhydrid . Det bruges almindeligvis som et reagens eller opløsningsmiddel , især i det industrielle miljø. Det opløser et stort antal olier , fedtstoffer eller harpikser (naturlige eller syntetiske). Under normale forhold er det en gennemsigtig væske med en karakteristisk lugt, der minder om malingfjerner eller beslægtet benzen .
Historisk
Forbindelsen blev først isoleret i 1837 ved destillation af fyrretræ olie fra det polske kemiker Philippe Walter (i) som døbte det " retinnapht ". I 1841 isolerede den franske kemiker Henri St. Clair Deville isolater af Tolu balsam (en) - et aromatisk ekstrakt fra det tropiske træ colombianske Myroxylon balsamum - Deville identificerer rétinnaphte Walter og benzen ; derefter kalder han dette nye kulbrinte ” benzoen ”. I 1843 anbefalede Jöns Jacob Berzelius navnet “ toluin ”. I 1850 isolerede den franske kemiker Auguste Cahours et carbonhydrid fra et trædestillat, som han genkendte som identisk med " benzenen " i Deville, som han døbte " toluen ".
Kemiske egenskaber
Toluen reagerer som et normalt aromatisk carbonhydrid ved elektrofil aromatisk substitution . Den methyl- gruppe gør den ca. 25 gange mere reaktive end benzen i den slags reaktioner. Ved sulfonering giver det paratoluensulfonsyre , mens dets klorering med chlor i nærværelse af jernchlorid giver en blanding af ortho- og para-isomerer af chlorotoluen. Nitrering med salpetersyre giver en blanding af ortho- og paranitrotoluen. Efter opvarmning fortsætter reaktionen med at give dinitrotoluen og til sidst trinitrotoluen (TNT), som er eksplosiv.
Den methyl- gruppe kan også reagere på andre oxidations- reaktioner . Den kaliumpermanganat giver benzoesyre , mens chromylchlorid giver benzaldehyd ( af Etard reaktion ). En halogenering under radikale betingelser giver benzylhalogenider. For eksempel opnås benzylbromid med N-bromsuccinimid i nærværelse af AIBN .
Den hydrogenering katalysator af toluenen giver methylcyclohexan . På grund af den særlige stabilitet i det aromatiske system kræver denne reaktion et højt brintryk .
Fysiske egenskaber
Toluen er en væske under normale temperatur- og trykforhold . Det er næsten uopløselig i vand ( 0,535 g l -1 ved 25 ° C ), men blandbar med mange organiske opløsningsmidler ( acetone , diethylether , chloroform , ethanol , etc. ), og opløselige i iseddikesyre. .
Toluen har en kryoskopisk molalkonstant på 3,55 ° C kg mol -1 og en ebullioskopisk molalkonstant på 3,40 ° C kg mol -1 . Dampen er tungere end luft og danner en eksplosiv blanding med sidstnævnte.
I proton-NMR vises toluen i form af adskillige toppe mellem 7,28 ppm og 7 ppm for hydrogenerne i benzenringen og af en singlet ved 2,38 ppm for hydrogenerne fra methylgruppen . I carbon-NMR præsenteres toluen i adskillige toppe ved 137,8 ppm for α-carbon af methyl, ved 129,09 ppm for β-carbonatomer, ved 128,28 ppm for y-carbonatomer og ved 125,38 ppm for carbon modsat methyl. Carbonet i methylgruppen viser en top ved 25 ppm .
Den termiske ledningsevne (i W · m -1 · K -1 ) er 0,1425 - 0,00025 T , med T udtrykt i ° C .
Fremstilling og syntese
Toluen er til stede i lav andel i råolie . Det produceres normalt ved katalytisk reformering i benzinproduktionsprocessen . Det opnås også ved krakning i fremstillingsprocessen af ethylen eller ellers fra kul . Dens endelige oprensning udføres ved destillation eller ved ekstraktion .
Produktion
I Frankrig, mellem de to krige, blev produktionen udført på bilaget pulverfabrik i Salin-de-Giraud (Bouches-du-Rhône). Denne virksomhed var ansvarlig for behandlingen af alle essenser, der kommer fra Borneo (kamfer), købt af pulverafdelingen, for at ekstrahere den nødvendige toluen til fremstilling af tolit . Det var den eneste fabrik af denne type i Frankrig, og man kan forestille sig den katastrofe, der ville have udgjort dens ødelæggelse eller simpelthen dens nedlukning. Under Anden Verdenskrig var dets produktion afgørende for fremstilling af kraftige sprængstoffer som TNT .
Den kemiske industri i USSR producerede 245.500 t af dette produkt mellem 1940 og 1945 hvortil der blev tilsat 103.000 t produceret af de allierede.
Den nazistiske Tyskland havde planlagt en produktion på 9.600 t i december 1939 , og i september 1944 , havde en produktion 15 500 t , men har endelig produceret, at 12 200 t .
Ifølge ECB producerede EU i 2003 næsten 16,75 millioner ton toluen hvert år, hvoraf 14 millioner var i form af blandinger inkorporeret i benzin og 2,75 millioner i form af kommerciel toluen.
To af de største producenter af dette produkt i 2006 er Total Petrochemicals og EniChem . I Frankrig , på samme dato, 163.854 t blev toluen produceret, 57.512 t importeret og 11.237 t eksporteres.
| Forenede Stater | 10.900 |
| Japan | 6.100 |
| Sydkorea | 3.080 |
| Kina | 2.830 |
| europæiske Union | 2.040 |
| Canada | 1.630 |
brug
Toluen anvendes:
- at hæve oktantallet i brændstoffer blandet med benzen og xylener. Det er derfor til stede i forskellige oliebrændstoffer;
- som en ekstraktion opløsningsmiddel i kosmetikindustrien (parfume) og i farmakokemiske industri;
- som opløsningsmiddel eller komponent til fremstilling af maling , lak, lak , voks og blæk ( trykning osv.);
- udgangsmateriale til forskellige industrielle processer : syntese af gummi , phenol , TNT , toluendiisocyanat (TDI), der er nødvendigt for at opnå skum af polyurethan , benzen og xylener, nitrotoluen, benzylchlorid, benzaldehyd, p - syretoluensulfon, vinyltoluen osv. ;
- til fremstilling af klæbemidler og lim;
- i garvning af læder ;
- som en booster for overfladerne hos visse bordtennisspillere (på trods af dets forbud).
Toksikologi, økotoksikologi, forholdsregler og stofskifte
Det er et skadeligt og økotoksisk produkt (ofte til stede i visse forurenede industrielle jordarter). Dens akutte toksicitet er lav, men dens primære målorganer er centralnervesystemet (hjerne, marv). Det er også irriterende for hud, øjne og åndedrætsorganer.
Hos forsøgsdyr inducerer udsættelse for betydelige niveauer af toluen generelle symptomer: hyperaktivitet, irritation af huden og især slimhinderne (løbende næse, tårer), irritation af luftvejene med åndenød. Ved eksponeringsniveauer over 2000 ppm i luft er det næste trin narkose ( ataksi , nedbrydning af kognitive funktioner, balanceforstyrrelser og neurokemiske ændringer. Døden skyldes åndedrætsstop. Induceret af udtømning af centralnervesystemet).
Irritationen øges med eksponeringens varighed og dosis: hos kanin, moderat erytem, så opstår der et let ødem efter 72 timer, irreversibelt efter 7 dage, og - altid hos kaninen - skylning af det eksponerede øje efter 4 og 30 sekunder ikke mindske irritationens intensitet.
Dets kroniske toksicitet er blevet undersøgt hos forsøgsdyr (mus, rotte), hvor vi observerer:
- en stigning i vægten af forskellige organer, der er involveret i afgiftning (lever, nyre, fx efter eksponering for 1.250 ppm i 15 dage hos rotter; ved 2.500 ppm vokser rotten fedt med en stigning i vægten af hjernen, hjertet, lungerne og testikler med symptomer på dyspnø og ataksi);
- en ændring i niveauet af neurotransmittere ;
- en neurotoksicitet, der især påvirker hippocampus og lillehjernen ;
- ototoksicitet hos rotter med en synergistisk interaktion med støj;
- lang eksponering (2 år ved 1500 ppm ) hos rotter inducerede betændelse i næseslimhinderne med erosion af det olfaktoriske epitel , metaplasi og degeneration af åndedrætsepitelet, men under 300 ppm blev der ikke observeret nogen symptomer. ( NOAEL eller koncentration uden observeret toksisk virkning var 625 ppm ved en eksponering på 6,5 timer om dagen, 5 dage om ugen i 15 uger eller 300 ppm over en eksponeringsperiode på 2 år. oral var NOAEL for rotter og mus 625 mg kg -1 d - 1 i 13 uger).
Toluen ser ikke ud til at have virkninger på DNA in vivo , hvorimod det har in vitro .
Via huden eller ved indånding ser det ikke ud til at være kræftfremkaldende , men som opløsningsmiddel kan det bidrage til indtrængen i kroppen af kræftfremkaldende produkter.
Toluen er reproduktionstoksisk (nedsat fertilitet ved hastigheder, hvor det ikke er giftigt for moderen hos rotter). Det forringer også mandlig fertilitet via en ændring i spermatogenese og / eller måske funktionen af epididymis: 20% reduktion i antallet af spermatozoer uden reduktion i deres mobilitet under 6000 ppm . Ud over dette falder antallet af spermatozoer såvel som deres mobilitet, men uden ændring af testikelvægt eller testikel spermatogenese og uden ændring i hormonniveauer efter en måneds eksponering [17]. Fertilitet påvirkes ikke under 600 ppm .
Det passerer let ind i fosteret og inducerer over 600 ppm hos dyr (ingen data for mennesker) forsinkelse af vækst og vægt ved fødslen og postnatale psykomotoriske lidelser, der afspejler neurotoksiciteten af toluen for den embryonale hjerne, dog uden eksterne misdannelser, herunder ved inhalation. Det vides ikke at være teratogent in vivo eller in vitro . EU har klassificeret det som reproduktionstoksisk, kategori 3 , R 63 .
Kinetik i kroppen
Selv i flydende form krydser den hudbarrieren dårligt (14 til 23 mg / cm 2 i timen) og i dampform endnu mindre (4,6 μg / cm 2 i timen for nøgne mus udsat for 1000 ppm , mens rottehud in vitro , absorberer 0,78 pg / cm 2 per minut.).
Imidlertid krydser den let lungeslimhinden i begge retninger (10-20% af toluen, der indtages og / eller inhaleres, udskilles derefter i form af damp via udløbet). Niveauet af udåndet benzen stiger efter indtagelse af ethylalkohol , hvor sidstnævnte hæmmer metabolismen af toluen, hvilket nedsætter dets udskillelse i urinen.
Indånding af toluen dampe er skadelig. I høje doser inducerer det kvalme . Langvarig kronisk indånding af toluen forårsager irreversibel hjerneskade . Fra lungerne transporteres det af blodet, halvt bundet til hæmoglobin og halvt i serum (hos mennesker; hos rotter transporteres det hovedsageligt med serum). Det kan påvises i blodet 10 til 15 minutter efter eksponeringens start (med en hastighed, der er højere, jo højere niveauet af benzen var i den indåndede luft; absorptionsgraden (ca. 50% af koncentrationen) afhænger også af hastighed af lungeventilation . Det kan derfor antages, at joggere, der løber nær en større cirkulationsakse, er mere udsat for den. Den passerer hurtigt gennem hjernen: eksperimentelt eksponerede rotter viser en top i blodet 53 minutter efter eksponering og 5 minutter senere ( 58 min ) i hjernen (rig på fedtvæv). det er også fundet i marven knogle og spinal , det fedtvæv , den lever og nyrer .
Toluen absorberes også meget godt via mave-tarmkanalen; med (hos mennesker og rotter) en påviselig top i blodet ca. to timer efter indtagelse.
Det filtreres næppe af placentabarrieren; hos rotter er koncentrationen i fosteret ca. 75% af koncentrationen i moderens blod. Modermælk, hvis den indeholder nogen, tillader også overførsel fra mor til barn (hos mennesker og dyr).
Den toksicitet toluen forklares ved dets metabolisme . Da toluen er meget dårligt opløselig i vand, kan den ikke forlade kroppen på traditionel måde (urin, fæces, sved). Det skal metaboliseres for at udskilles . Den methyl gruppe toluen oxiderer lettere end den aromatiske ring. Denne reaktion udføres i leveren af cytochrom P450 monooxygenaser . Som et resultat omdannes 95% af toluen til benzylalkohol . Det er de resterende 5%, der skaber de giftige metabolitter, epoxierne i den aromatiske kerne. Det store flertal af disse epoxider er konjugeret til glutathion , men det lille, der formår at undslippe, beskadiger cellemaskineriet alvorligt ved at gå til alkylering af visse proteiner , endda DNA'et .
Toluen udskilles hovedsageligt via urinen som benzoesyre - opnået ved enzymatisk oxidation af benzylalkohol - og som hippursyre opnået ved konjugering af benzoesyre med glycin .
Synergier
Mange synergier er sandsynlige, da toluen er et stærkt opløsningsmiddel. Det er for eksempel kendt, at toluen- xylen- kombinationen inducerer, ved metabolisk konkurrence, en stigning i niveauet (blod og cerebral) af toluen.
Bindende grænseværdier for erhvervsmæssig eksponering
I Frankrig er de 20 ppm eller 77 mg m -3 (8 h) og 100 ppm 384 mg m -3 (til kortvarig eksponering eller 15 min ) udarbejdet ved dekret nr . 2012-746 af9. maj 2012. Disse værdier anvendes især til at foretage regulatorisk dosimetri bestemt ved dekret nr . 2009-1570 af15. december 2009.
Noter og referencer
- TOLUENE , sikkerhedsark (er) til det internationale program om sikkerhed for kemiske stoffer , hørt den 9. maj 2009
- (i) David R. Lide, Handbook of Chemistry and Physics , Boca Raton, CRC,16. juni 2008, 89 th ed. , 2736 s. ( ISBN 978-1-4200-6679-1 ) , s. 9-50
- (i) Hyp J. Daubensee Jr. , James D. Wilson og John L. lægfolk " diamagnetisk modtagelighed Ophøjelse i kulbrinter " , Journal of American Chemical Society , Vol. 91, nr . 8,9. april 1968, s. 1991-1998
- (in) Yitzhak Marcus, The Properties of Solvents , vol. 4, England, John Wiley & Sons ,1999, 239 s. ( ISBN 0-471-98369-1 ) , s. 85
- beregnet molekylmasse fra " Atomic vægte af elementerne 2007 " på www.chem.qmul.ac.uk .
- (i) Iwona Owczarek og Krystyna Blazej, " Anbefalede kritiske temperaturer. Del II. Aromatiske og cykliske carbonhydrider ” , J. Phys. Chem. Ref. Data , vol. 33, nr . 230. april 2004, s. 541 ( DOI 10.1063 / 1.1647147 )
- (i) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 nd ed. , 1076 s. ( ISBN 978-0-387-69002-5 og 0-387-69002-6 , læs online ) , s. 294
- (i) JG Speight og Norbert Adolph Lange , Langes Handbook of Chemistry , McGraw-Hill,2005, 16 th ed. , 1623 s. ( ISBN 0-07-143220-5 ) , s. 2.289
- (da) Robert H. Perry og Donald W. Green , Perrys kemiske ingeniørhåndbog , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50
- Teknisk ingeniørudgaver, artikel B 1201
- " Egenskaber ved forskellige gasser " på flexwareinc.com (adgang til 12. april 2010 )
- (i) Carl L. kæberne, Handbook of Termodynamiske Diagrams: Organic Compounds C8 til C28 , vol. 2, Huston, Texas, Gulf Pub.,1996, 396 s. ( ISBN 0-88415-858-6 )
- (i) David R. Lide , Gummibibelen , Boca Raton, CRC Press,18. juni 2002, 83 th ed. , 2664 s. ( ISBN 0849304830 , online præsentation ) , s. 5-89
- " ESIS " (adgang til 6. december 2008 )
- IARC-arbejdsgruppen om evaluering af kræftfremkaldende risici for mennesker, " Evalueringer Globales de la Carcinogenicité pour l'Homme, Gruppe 3: Uklassificerede med hensyn til deres kræftfremkaldende virkning på mennesker " , på monografier.iarc.fr , IARC,16. januar 2009(adgang til 22. august 2009 )
- Indeksnummer i tabel 3.1 i tillæg VI til EF-regulativ nr. 1272/2008 (16. december 2008)
- " Toluen " i kemikaliedatabasen Reptox fra CSST (Quebec-organisation med ansvar for arbejdsmiljø), åbnet den 25. april 2009
- Acceptable daglige koncentrationer / indtag og tumorigene koncentrationer / doser af prioriterede stoffer beregnet i henhold til sundhedskriterier , offentliggjort af Health Canada
- " Toluen " på hazmap.nlm.nih.gov (adgang 14. november 2009 )
- Pelletier og Walter (1837) "Gennemgang af produkter fra harpiksforarbejdning til fremstilling af gas til belysning" , Proceedings , 4 : 898–899.
- Pelletier og Philippe Walter (1838) "Undersøgelse af produkter, der er resultatet af behandling af harpiks ved fremstilling af gas til belysning," Annales de Chimie et de Physique , 2. serie, 67 : 269-303. Toluen hedder pp. 278-279: ”Vi vil betegne det stof, der vedrører os, med navnet retinnaphtus , der minder om dets oprindelse og dets fysiske egenskaber (ρητίνη-νάφτα). "
- Deville (1841) " Undersøgelser af harpikser. Undersøgelse af Tolu balsam", Proceedings , 13 : 476–478.
- H. Deville (1841) " Kemiske undersøgelser af harpikser; Første erindringsbog" (Kemiske undersøgelser af harpikser; første erindringsbog), Annales de Chimie et de Physique , 3. serie, 3 : 151-195. Deville navngiver toluen på s. 170: ”For det legeme, der vedrører mig i øjeblikket, har jeg vedtaget navnet benzen , der i balsamerne, hvorfra det kommer, minder om denne næsten generiske karakter, som skal indeholde benzoesyre. "
- Jaime Wisniak , " Henri Étienne Sainte-Claire Deville: En læge blev metallurg ", Journal of Materials Engineering and Performance , vol. 13, nr . 22004, s. 117–118 ( DOI 10.1361 / 10599490418271 , Bibcode 2004JMEP ... 13..117W )
- Jacob Berzelius (1843) Jahres Berichte , 22 : 353-354. .
- Cahours, Auguste (1850) "Forskning i lette olier opnået ved destillation af træ" (Undersøgelser af lette olier opnået ved destillation af træ), Rapporter , 30 : side 320
- Jaime Wisniak (oktober 2013) "Auguste André Thomas Cahours," Educación Química , 24 (4): 451–460.
- Sovjetunionens økonomi i 1941-1945
- (in) Tillæg D. Strategisk luftangreb på pulver- og eksplosivindustrien: Tabel D6 Anlæg til produktion af råmaterialer til pulver og eksplosiver
- INERIS - Tekniske og økonomiske data om kemiske stoffer i Frankrig: Toluen [PDF]
- Aromatiske kulbrinter , French Society of Chemistry
- Campo P. et al. , Toluen-induceret høretab: En midfrekvensplacering af cochlea-læsioner , Neurotoksikologi og Teratologi , 1997, 19: 129-40.
- Søren Lund og Gitte Kristiansen , ” Farer for hørelse fra kombineret eksponering for toluen og støj hos rotter ”, International Journal of Occupational Medicine and Environmental Health , bind. 21, nr . 1,1 st januar 2008( ISSN 1896-494X og 1232-1087 , DOI 10.2478 / v10001-008-0008-x , læs online , adgang til 26. februar 2019 )
- R. Lataye og P. Campo , ” kombinerede virkninger af en samtidig eksponering for støj og toluen ved at høre funktion ”, Neurotoxicology og Teratology , vol. 19, nr . 5,September 1997, s. 373–382 ( ISSN 0892-0362 , PMID 9380004 , læst online , adgang til 26. februar 2019 )
- Guillot J.-P. et al. , Evaluering af det kutane irritationspotentiale for 56 forbindelser , Food and Chemical Toxicology , 1982, 20: 563-572.
- Guillot J.-P. et al. , Evaluering af okulært irritationspotentiale for 56 forbindelser , Food and Chemical Toxicology , 1982, 20: 573-582.
- Toksicitet sammendrag for toluen. Toksicitetsprofiler, Risikovurderingsinformationssystem , 1994. Findes på http://risk.lsd.ornl.gov/tox/rap_toxp.shtml
- Toksikologi- og carcinogenesestudier af toluen (CAS-nr. 108-88-3) i F344 / N-rotter og B6C3F1-mus (inhalationsstudier) , Toksicitetsanalyse TR- 371, NTP, 1990. Link NIEHS
- Toluen . I: IARC monografier om evaluering af kræftfremkaldende risici for mennesker , Lyon: IARC, 1999, 71 (2); 829-864.
- Toksikologi- og carcinogenesestudier af toluen (CAS-nr. 108-88-3) i F344 / N-rotter og B6C3F1-mus (inhalationsstudier) , Toksicitetsanmeldelse TR-371, NTP; 1990. NIEHS websted
- Toluen , toluenark fra DEMETER. Dokumenter til medicinsk vurdering af reproduktionstoksiske produkter , INRS, 2006
- Dalgaard M. et al. , Udviklingstoksicitet af toluen hos hanrotter: virkninger på sædkvalitet, testikelmorfologi og apoptotisk neurodegeneration , Archives of Toxicology , 2001, 75 (2): 103-109.
- Wilkins-Haug L., Teratogen-opdatering: toluen , Teratology , 1997, 55: 145-151.
- Ono A. et al. , Toluen inhalation induceret epididymal sæddysfunktion hos rotter , Toxicology , 1999, 139 (3): 193-205.
- INRS toksikologisk ark, tilgængelig via de eksterne links på denne side
Se også
Relaterede artikler
- Xylen , benzen med to methylgrupper
- Nitrotoluen , toluen substitueret med en nitrogruppe
- Dinitrotoluen , toluen substitueret med to nitrogrupper
- Trinitrotoluentoluen substitueret med tre nitrogrupper
- Toluidin , toluen substitueret med en amingruppe
eksterne links
- Toksikologisk ark , INRS.
- Biotox-database , INRS.
- International sikkerhedsdatablad på www.cdc.gov .