Pummerer omlejring
Den omlejring Pummerer er en organisk reaktion , hvor et sulfoxid med alkyl er omlejret i et α- acyloxy - thioether (mono thioacetal -esteren) i nærvær af eddikesyreanhydrid .

Reaktionens støkiometri er:
RS (O) CHR ' 2 + Ac 2 O → RSC (OAc) R' 2 + AcOHHistorie
Reaktionen blev opdaget af den østrigske kemiker Rudolph Pummerer i 1909.
Syntetisk implementering
Den eddikesyreanhydrid , den trifluoreddikesyreanhydrid og trifluormethansulfonsyreanhydrid blev anvendt som aktivatorer. Udover acetater er de mest almindelige nukleofile arener , alkener , amider og phenoler .
Anvendelsen af a-acylsulfoxides og Lewis-syre , såsom TiCl 4 og SnC 4 , tillader reaktionen at finde sted ved lavere temperaturer ( 0 ° C ).
Den thionylchlorid kan anvendes i stedet for eddikesyreanhydrid til at udløse eliminering til dannelse af mellemproduktet og give elektrofilt chlorid som nukleofilen til opnåelse af en α-chlor-thioether:

Andre acylanhydrider og halogenider kan give lignende produkter. Uorganiske syrer kan også give denne reaktion. Dette produkt kan omdannes til et aldehyd eller en keton ved hydrolyse .
Mekanisme
Pummerer-omlægningens mekanisme begynder med acylering af sulfoxidet ( resonansstrukturer 1 og 2 ) med eddikesyreanhydrid til opnåelse af 3 med acetat som et biprodukt. Acetatet derefter fungerer som en katalysator for at inducere en elimineringsreaktion til frembringelse af den cationic- thial struktur 4 , med eddikesyre som et biprodukt. Endelig angriber acetatet thialen for at give slutproduktet 5 .

Den aktiverede thial elektrofil kan fanges af forskellige intramolekylære og intermolekylære nukleofiler til dannelse carbon-carbon -bindinger og carbon-heteroatom-bindinger.
Mellemproduktet er så elektrofilt, at de samme neutrale nukleofiler kan anvendes, herunder aromatiske ringe med elektrondonerende grupper, såsom 1,3-benzodioxol (in) :
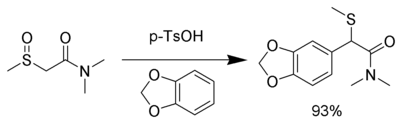
Det er muligt at udføre omlægningen ved hjælp af selen i stedet for svovl.
Pummerer fragmentering
Når en substituent i a-positionen kan danne en stabil carbocation , fjernes denne gruppe snarere end a- hydrogenatomet i det mellemliggende trin. Denne variation kaldes en " Pummerer-fragmentering ". Et eksempel på denne type reaktion er reaktionen mellem et sulfoxid og trifluoreddikesyreanhydrid (TFAA):

Den organiske gruppe R2 vist i diagrammet ovenfor nederst til højre er carbocation af methylviolet , hvis pK R + på 9,4 ikke er tilstrækkelig til at kompensere for tabet af H +, og derfor sker en klassisk omlejring af Pummerer. Reaktionen til venstre er fragmentering, fordi den fraspaltelige gruppe med pK R + = 23,7 er særlig stabil.
Se også
- Organisk svovlforbindelse
- Polonovski- reaktion, lignende reaktion, der involverer en aminoxid
Referencer
- (fr) Denne artikel er helt eller delvist taget fra den engelske Wikipedia- artikel med titlen " Pummerer-omlejring " ( se forfatterliste ) .
- Ottorino de Lucchi , Umberto Miotti og Giorgio Modena , The Pummerer Reaction of Sulfinyl Compounds , vol. 40,1991, 157–184 s. ( ISBN 978-0471264187 , DOI 10.1002 / 0471264180.or040.03 )
- Padwa, Gunn og Osterhout, " Anvendelse af Pummerer-reaktionen mod syntese af komplekse carbocykler og heterocykler ", Synthesis , bind. 1997 nr . 121997, s. 1353–1377 ( DOI 10.1055 / s-1997-1384 )
- Padwa, Bur, Danca og Ginn, " Linked Pummerer-Mannich Ion Cyclizations for Heterocyclic Chemistry ", Synlett , vol. 2002 nr . 6,2002, s. 851–862 ( DOI 10.1055 / s-2002-31891 )
- Pummerer, “ Über Phenyl-sulfoxyessigsäure ”, Chemische Berichte , bind. 42, nr . 21909, s. 2282–2291 ( DOI 10.1002 / cber.190904202126 )
- Pummerer, “ Über Phenylsulfoxy-essigsäure. (II.) ”, Chemische Berichte , bind. 43, nr . 21910, s. 1401–1412 ( DOI 10.1002 / cber.19100430241 , læs online )
- Smith, Coote, Sneddon og Procter, " Beyond the Pummerer Reaction: Recent Developments in Thionium Ion Chemistry ", Angewandte Chemie International Edition , bind. 49, nr . 34,2010, s. 5832–44 ( PMID 20583014 , DOI 10.1002 / anie.201000517 ).
- Stamos, " Arylering af α-phosphorylsulfider via deres pummerer-omlejringsmellemprodukter genereret fra de tilsvarende sulfoxider ", Tetrahedron Letters , bind. 27, nr . 51,1986, s. 6261-6262 ( DOI 10.1016 / S0040-4039 (00) 85447-7 ).
- Kosugi, Watanabe og Uda, " Lewis-syre-medieret kulstof-kulstofbindingsdannende reaktion ved anvendelse af Pummerer-omlejringsprodukter fra Chiral beta-hydroxy sulfoxider ", Chemistry Letters , bind. 18, nr . 10,1989, s. 1865–1868 ( DOI 10.1246 / cl.1989.1865 )
- Meffre, Durand og Le Goffic, " Methyl (S) -2-phthalimido-4-methylthiobutanoat ", Organic Syntheses , bind. 76,1999, s. 123 ( DOI 10.15227 / orgsyn.076.0123 ).
- Ishibashi, Miki, Ikeda og Kiriyama, “ Syntese af α- (methylthio) arylacetamider og deres omdannelse til nogle biologisk aktive arylethylaminer ”, Biological & Pharmaceutical Bulletin , bind. 37, nr . 12,1989, s. 3396–3398 ( DOI 10.1248 / cpb.37.3396 ).
- Gilmour, Prior, Burton Holmes, " En organokatalytisk tilgang til kernen i eunicellin " Chemical Communications , nr . 38,2007, s. 3954 ( DOI 10.1039 / B709322E ).
- Laleu, Santarém Machado og Lacour, “ Pummerer-fragmentering vs. Pummerer-omlægning: en mekanistisk analyse ", Chemical Communications , nr . 26,25. maj 2006, s. 2786–2788 ( DOI 10.1039 / b605187a )