Hydroniumion
| Hydroniumion | |
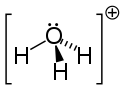   Struktur af hydroniumion. |
|
| Identifikation | |
|---|---|
| IUPAC navn | oxonium |
| N o CAS | |
| PubChem | 123332 |
| ChEBI | 29412 |
| SMILE |
[OH3 +] , |
| InChI |
InChI: InChI = 1S / H2O / h1H2 / p + 1 InChIKey: XLYOFNOQVPJJNP-UHFFFAOYSA-O |
| Kemiske egenskaber | |
| Brute formel | H 3 O + (aq) |
| Molar masse | 19,0232 ± 0,0005 g / mol H 15,9%, O 84,1%, |
| pKa | -1,74 ved 25 ° C |
| Enheder af SI og STP, medmindre andet er angivet. | |
Den hydroniumion er den enkleste af oxoniumioner ; dens kemiske formel er H 3 O +eller H + (aq). I vandig opløsning , er det solvatiseret af en række molekyler af vand og kan skrives H 7 O 3 +H 9 O 4 +etc. Det skyldes protonering af et vandmolekyle enten ved en syre eller ved autoprotolyse af vand. Det eksisterer også i fast tilstand og i gas tilstand. Det er også en ion, der findes i det interstellære medium , hvor den skyldes interaktion mellem vandmolekyler og kosmisk stråling .
Nomenklatur
Den IUPAC-nomenklaturen for organisk kemi anbefaler udpegning af H 3 O + ionaf oxonium . Udtrykket hydroxonium kan også bruges til at undgå tvivl . Et udkast til IUPAC-anbefaling vil også anbefale brugen af udtrykket oxidanium i forbindelse med uorganisk kemi specifikt, men dette navn er i øjeblikket usædvanligt i praksis.
Geometri
Da O + ionen og N- atomet har det samme antal elektroner , er H 3 O + ionener isoelektronisk med molekyle af ammoniak NH 3dermed dens trigonale pyramidegetri med øverst oxygenatom. HOH- vinklen er i størrelsesordenen 113 °.
Solution
Den solvatisering af hydroniumion i vand endnu ikke er fuldt karakteriseret. Den dominerende geometri udledt fra kryoskopi af vand ville være H 3 O + (H 2 O) 6 : hver ion er i gennemsnit solvatiseret af seks vandmolekyler, som ikke længere kan solvere en anden ion.
Andre opløsningsstrukturer involverer flere vandmolekyler, især H 3 O + (H 2 O) 20hvor hydroniumionen er i centrum af en vanddodecahedron . Simuleringer udført af ab initio metode af kvantekemi vil dog indikere, at det hydratiserede proton ville være placeret i gennemsnit snarere på overfladen af H 3 O + (H 2 O) aggregat 20.
Et californisk hold foreslog i 2010 en ny model baseret på dets infrarøde spektroskopianalyser , ifølge hvilke protoner er solvatiseret i form af aggregater [H 13 O 6 ] +hvor den positive elektriske ladning fordeles uden forskel på de seks vandmolekyler.
Den H 3 O + monomerVæskefasen blev identificeret i 1979 af kernemagnetisk resonans i oxygen 17 i en opløsning supersyre svagt ikke-vandige nukleofile HF-SBF 5 SO 2( hydrogenfluorid , antimonpentafluorid , svovldioxid ).
Oxoniumion er permanent til stede i vand på grund af autoprotolysereaktionen :
- Først og fremmest er der dissociation af et vandmolekyle: H 2 O H + + HO -
- Derefter solvatiserer et andet vandmolekyle den frigivne proton: H 2 O+ H + H 3 O +
- Endelig solvatiserede proton opnået, kaldet oxonium ion , hydratiseres i opløsning og derfor betegnet H 3 O + (aq), forkortet som "vandig" med henvisning til det faktum, at den er i opløsning.
Den overordnede reaktionsplan kan skrives:
2 H 2 O H 3 O + (aq) + HO - (aq)HO - (aq)er hydroxidionen , også solvatiseret.
pH i rent vand ved 25 ° C
Den ligevægtskonstant af autoprotolysis vand ved 25 ° C er:
K eq = [H 3 O +] × [HO - ] / [H 2 O] 2 = 10-14 .En ligevægtskonstant gælder ikke for koncentrationer, men for aktiviteter. Vandaktivitet H 2 O opløsningsmiddel er det for en praktisk talt ren væske og er lig med 1 ved konvention.
Ioniseringskonstanten for vand ved 25 ° C skrives:
K e = K eq x [H 2 O] 2 = [H 3 O +] × [HO - ] = 10-14 ,hvilket betyder at :
[H 3 O +] = [HO - ] = 10-7 ,deraf pH- værdien af rent vand ved 25 ° C :
pH = - log 10 ([H 3 O +]) = 7.Den oxonium ion er ansvarlig for ejendommen af syrer ifølge definitionen af Joannes Brønsted . Den er til stede i enhver vandig opløsning i ligevægt med hydroxidionen HO - . Det er målingen af dens koncentration, der gør det muligt at bestemme opløsningens pH .
Referencer
- [1]
- beregnet molekylmasse fra " Atomic vægte af elementerne 2007 " på www.chem.qmul.ac.uk .
-
(en) Jian Tang og Takeshi Oka , " infrarød spektroskopi af H 3 O +
: The v 1 Fundamental Band ” , Journal of Molecular Spectroscopy , bind. 196, nr . 1,Juli 1999, s. 120-130 ( læs online )
DOI : 10.1006 / jmsp.1999.7844 -
DOI : 10.1021 / ja9101826 -
(i) Gheorghe D. Mateescu, George M. Benedikt , " Vand og relaterede systemer. 1. hydroniumion (H 3 O +
). Foruddelning og karakterisering ved hjælp af ilt-17 nuklear magnetisk resonans med høj opløsning ” , Journal of the American Chemical Society , bind. 101, nr . 14,1979, s. 3959-3960 ( læs online )
DOI : 10.1021 / ja00508a040
