Alkohol (kemi)
I organisk kemi , en alkohol er en organisk forbindelse, i hvilken en af carbon -atomer (hvor sidstnævnte er tetraedriske ) er bundet til en hydroxylgruppe gruppe (-OH). Den ethanol, der anvendes i sammensætningen af alkoholholdige drikkevarer, er en særlig alkoholtilfælde. Den methanol og ethanol er højdosis toksisk og dødelig.
Nomenklatur
Når alkohol er hovedfunktionen, er det tilstrækkeligt at erstatte terminalvokalen "e" for den tilsvarende alkan med suffikset - ol og angive antallet af det carbonatom , hvor hydroxylgruppen er bundet, skønt det undertiden ikke er nødvendigt for beskrivelsen er sidstnævnte information udeladt.
Hvis det ikke er hovedfunktionen, er det nødvendigt at tilføje præfikset hydroxy forud for antallet af det carbonatom, hvor gruppen er knyttet.
For den konjugerede alkoholbase, alkoholationen (se afsnittet om surhed ), er det tilstrækkeligt at erstatte den terminale vokal "e" med suffikset -olat (ikke at forveksle med suffikset -oatkarakteristikken for carboxylat, konjugeret base af den carboxylsyre ).
Eksempler:
- ethanol:
- butan-2-ol:
- 3-hydroxy-propansyre:
Klassifikation
Generelt indeholder en alkohol derfor sekvensen
R - OHhvor R er en variabel organisk gruppe, ofte en alkyl .
Afhængig af arten af det kulstof, der bærer alkoholgruppen, kan vi skelne mellem:
- de primære alkoholer , i hvilke carbon indeholdende hydroxylgruppen er bundet til mindst to atomer hydrogen og en organisk gruppe R:

- de sekundære alkoholer , i hvilke carbon indeholdende hydroxylgruppen er bundet til et hydrogen og to organiske grupper R og R ':

- de tertiære alkoholer , i hvilke carbon indeholdende hydroxylgruppen er bundet til tre organiske grupper R, R 'og R ":

- De phenoler , betragtes undertiden individuelle alkoholer, i hvilke hydroxylgruppen er bundet til et carbonatom i en benzenring . Deres reaktivitet er så forskellig fra den for andre alkoholer (her er det carbon, der bærer -OH-gruppen ikke tetraedrisk ), phenoler klassificeres generelt uden for alkoholfamilien.
- Der er også en gruppe, der undertiden betragtes som et specielt tilfælde af alkoholer kaldet enoler . Dette er et molekyle, hvor hydroxylgruppen er bundet til et carbon med en C = C dobbeltbinding (her er det carbon, der bærer -OH-gruppen igen, ikke tetraeder). Det er faktisk en tautomer form af et aldehyd eller en keton . Den dominerende form er generelt aldehyd eller keton og ikke enol, undtagen i særlige tilfælde, hvor enolformen er stabiliseret ved mesomerisme såsom phenoler.
Produktion og syntese
Alkoholer kan produceres ved alkoholfermentering , herunder methanol fra træ og ethanol fra frugt og korn. Industrien bruger kun ethanol til at producere brændstof og drikkevarer. I de andre tilfælde syntetiseres alkoholerne fra organiske forbindelser opnået fra naturgas eller råolie, især ved hydratisering af alkenerne.
Brug
Alkoholer anvendes i den kemiske industri som:
- opløsningsmidler : ethanol, som ikke er særlig giftig, bruges i parfume og medicin ;
- brændstoffer : methanol og ethanol kan erstatte benzin og brændselsolie, fordi deres forbrænding ikke producerer giftige dampe;
- reaktanter : polyurethaner , estere eller alkener kan syntetiseres ud fra alkoholer;
- frostvæske : den lave størkningstemperatur for visse alkoholer såsom methanol og ethylenglycol gør dem til gode frostvæsker.
Fysisk-kemiske egenskaber
Aspekt
Alkoholer med lav molekylvægt vises ved stuetemperatur som farveløse væsker; tungere alkoholer såsom hvidlige faste stoffer.
Polaritet og tilstedeværelse af hydrogenbindinger
Hydroxylgruppen gør generelt alkoholmolekylet polært . Dette er på grund af sin geometri (bøjet, af type AX 2 E 2 ), og de respektive elektronegativitet af carbon, oxygen og hydrogen (χ (O)> χ (C)> χ (H)). Disse grupper kan danne hydrogenbindinger med hinanden eller med andre forbindelser (hvilket forklarer deres opløselighed i vand og i andre alkoholer).
Kogepunkt
Den kogepunkt er højt i alkoholer:
- på grund af hydroxylgruppen, som tillader hydrogenbindinger;
- på grund af kulstofkæden, der gennemgår van der Waals kræfter .
Kogepunktet for alkoholer er også desto højere, hvis:
- antallet af alkoholfunktioner er stort: en diol har et højere kogepunkt end den tilsvarende ækvivalente alkohol, som i sig selv har et højere kogepunkt end det tilsvarende carbonhydrid. Blandt de alkoholer, der stammer fra isopropan, koger glycerol (propan-1,2,3-triol) for eksempel ved 290 ° C , propylenglycol (propan-1,2-diol) ved 187 ° C , propan -1-ol ved 97 ° C og propan ved -42,1 ° C ;
- kulstofkæden er lang: blandt lineære alkoholer koger methanol ved 65 ° C , ethanol ved 78 ° C , propan-1-ol ved 97 ° C , butan-1-ol ved 118 ° C , pentan-1-ol ved 138 ° C og hexan-1-ol ved 157 ° C ;
- kulstofkæden er lineær ved at maksimere molekylets overfladeareal, der er i stand til at gennemgå van der Waals-kræfter . For eksempel blandt pentanoler, 2,2-dimethylpropan-1-ol ved 102 ° C , 2-methylbutan-1-ol ved 131 ° C og 1-pentanol ende til 138 ° C .
Opløselighed
Den vandopløselighed af alkoholer afhænger af de samme to faktorer som ovenfor, men som er antagonistiske her:
- den hydrofobe carbonkæde har tendens til at gøre molekylet uopløseligt;
- hydroxylgruppen, hydrofil (takket være dens hydrogenbindinger), har en tendens til at gøre molekylet opløseligt.
Alkoholer er således desto mere opløselige i vand, når:
- kulstofkæden er kort: methanol, ethanol og propan-1-ol er opløselige i alle forhold i vand, butan-1-ol har en opløselighed på 77 g L -1 ved 20 ° C , 1-pentanol på 22 g L - 1 , 1-hexanolen til 5,9 g L- 1 , 1-heptanolen på 2 g L- 1 og tungere alkoholer er praktisk talt uopløselige;
- antallet af alkoholfunktioner er højt. For eksempel er butandioler opløselige i alle proportioner, mens butan-1-ol har en opløselighed på 77 g L -1 ;
- carbonkæden er forgrenet: blandt pentanolerne har 2,2-dimethyl-propan-1-ol en opløselighed på 102 g L- 1 , 2-methyl-butan-1-ol har 100 g L -1 og 22 g L −1 pentan-1-ol .
Alkoholer med lav molekylvægt er generelt opløselige i organiske opløsningsmidler, såsom acetone eller ether .
Reaktivitet
Surhed
På grund af OH-bindingDen stærke polarisering af OH bindingen giver mulighed for en ionisk brud: alkoholerne udgør derfor svage syrer , og endda meget svag (pKa en generelt mellem 16 og 18, 10 for phenolerne, i vand) ved frigivelse af en H + kation fra hydroxylgruppen. De er derfor meget svagere end vand (med undtagelse af methanol) og manifesterer kun deres sure karakter i ikke-vandige opløsninger ved f.eks. At reagere med basen NaIKKEH 2i ammoniakopløsning . Den konjugerede base af en alkohol kaldes en alkoholat (eller alkoxid ) ion .
På grund af frie iltdubletterEn af de frie iltdubletter er i stand til at fange en proton: Alkoholen er derfor en Brönsted-base , ligeglad (pK A (ROH 2 + / ROH) på ca. -2), dens konjugerede syre, l Alkyloxoniumionen er en stærk syre, kan kun være til stede i en meget lille mængde (undtagen i nærværelse af en høj koncentration af stærk syre).
Takket være reaktiviteten af disse dubletter er alkohol også en Lewis-base .
Nukleofili
Alkoholer er meget gode nukleofiler , en egenskab der altid skyldes reaktiviteten af de frie iltdubletter, hvilket også er en hurtig reaktion.
Nukleofugacity
- Når CO-bindingen er polariseret, er der en mulighed for ionisk brud: R-OH → R + + HO - . Imidlertid forbliver dette brud meget vanskeligt, hvilket gør hydroxylgruppen til en dårlig nucleofuge (forlader gruppe).
- Imidlertid er forstyrrelse i sin protonerede form, alkyloxoniumionen , meget lettere.
Denne egenskab tillader det især, som vi vil se nedenfor, at deltage i nukleofile substitutionsreaktioner og eliminationsreaktioner.
Reaktioner
Nukleofil substitutionsreaktion
Alkoholer kan gennemgå nukleofil substitution , hvor hydroxylgruppen erstattes af en anden nukleofil gruppe .
Transformation til etheroxid Skift fra alkohol til haloalkaner Fra en hydracid ReaktionAlkohol reagerer med en hydrid ( hydrogenchlorid , bromid, fluor eller iodid) til dannelse af en halogenalkan :
R-OH + HX → RX + H 2 O, X, der repræsenterer halogen Cl , Br , I eller FDette er den omvendte reaktion af hydrolysereaktionen af halogenerede derivater.
Ejendomme- reaktionen er langsom og reversibel;
- det foretrækkes i direkte retning, hvis hydraciden er koncentreret og i overskud, i den anden retning i tilfælde af overskydende vand og i et basisk medium;
- dens stereokemi afhænger af reaktionsmekanismen og derfor af alkoholklassen;
- det er mere eller mindre langsomt og mere eller mindre begrænset afhængigt af:
- alkoholklassen: R I OH <R II OH <R III OH ("<" betyder "reagerer mindre hurtigt og på en mere begrænset måde end")
- hydracids natur: HF << HCI <HBr <HI (i praksis anvendes ikke HF, reaktionen er alt for langsom).
Afhængig af alkoholklassen er begrænsende mekanismer mulige:
- en primær alkohol (derfor ikke sterisk hindrede ) vil reagere ifølge en S N 2 typen mekanisme . Alle egenskaberne er derfor af en S N2 (relativ inversion af konfiguration, enantierospecificitet osv.);
- en tertiær alkohol følger en S N 1 typen mekanisme : faktisk den tertiære carbokation , er relativt stabilt. Egenskaberne er derfor dem af en S N 1 (ikke-stereoselektivitet, racemisering hvis det carbonatom, der bærer hydroxylgruppen er asymmetrisk osv);
- en sekundær alkohol kan følge en S N 1 typen mekanisme , eller endda en mellemliggende mekanisme mellem S N 1 og S N 2.
- disse reaktioner, der passerer gennem et carbocation-mellemprodukt, kan forårsage omlejringer af carbonkæden;
- disse reaktioner kan katalyseres af en Lewis-syre, såsom zinkchlorid. Derefter dannes et addukt , hvilket fører til dannelsen af en carbocation (HOZnCl 2 er en bedre startgruppe end OH 2) og derved lette tilsætningen af halogenet;
- denne reaktion kan udvides til at omfatte andre syrer, såsom phosphorsyre og svovlsyre;
- denne reaktion bruges meget lidt i syntese, fordi den er for langsom. Tosylchlorid anvendes snarere til at danne et tosylat, som er en meget god fraspaltelig gruppe.
Forskellige forbindelser kan bruges til at tillade halogenering af alkoholer.
- De mest almindelige reagenser til chlorering er phosgen (COCl 2), Thionylchlorid (SOCl 2), phosphoroxichlorid (POCl 3) og phosphorchlorider (PCl 3) og PCl 5).
- For en bromering (PBr 3) og parret CBr 4 / triphenylphosphin.
- Iodider syntetiseres generelt ved fortrængning af et chlorid med Najeg i acetone (Najeg er opløselig i y, i modsætning til NaCl, hvis nedbør er reaktionens drivkraft).
Elimineringsreaktion (dehydrering)
Alkoholer kan undergå en vand elimination reaktion ( dehydratiseringsreaktion ) ved høj temperatur i et surt medium og producere alkener:
VSH 3- CH 2- OH → CH 2 = CH 2+ H 2 O.Denne reaktion kan vendes for at syntetisere alkoholer fra alkener og vand ( hydratiseringsreaktion af alkener), men forbliver upålidelig, fordi den producerer blandinger af alkoholer.
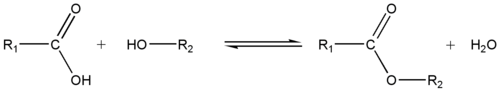
Forestring
Ved at reagere med en carboxylsyre danner alkoholen en ester .
Oxidation
Alkoholer kan oxideres til aldehyder, ketoner eller carboxylsyrer.
Reduktion
Alkoholer kan reduceres til alkaner ved hjælp af tributyltin ved en radikal substitution kaldet Barton-McCombie-reaktionen.
Eksempler
- Mono-alkoholer:
- den methanol , CH 3 (OH), afledt af methan ;
- den ethanol , CH 3 -CH 2 (OH), afledt af etan ;
- de to isomerer af propanol , C 3 H 8 O, afledt af propan ;
- de fire isomerer af butanol , C 4 H 10 O, derivat af butan ;
- de otte isomerer af pentanol , C 5 H 12 O, derivat af pentan ;
- de sytten isomerer af hexanol , C 6 H 14 O, derivat af hexan ;
- heptanol isomerer såsom heptan-1-ol , C 7 H 16 O, derivat af heptan ;
- de fede alkoholer med mindst 8 carbonatomer;
- den diol :
- den ethylenglycol (eller ethan-1,2-diol), CH 2 (OH) -VSH 2 (OH) ;
- de sukkeralkoholer :
- den glycerol (eller propan-1,2,3-triol), CH 2 (OH) -VSH(OH) -VSH 2 (OH) ;
- den aminoalkoholen : organiske forbindelser, som indeholder både en funktionel gruppe amin og en alkohol funktionel gruppe;
- den aldol : organiske forbindelser, der indeholder en gruppe aldehyd og en alkohol-gruppe;
- de ketoler og acyloiner : organiske forbindelser, der indeholder en gruppe keton og en alkoholgruppe.
Toksicitet
Ethanol er et giftigt eller endog dødeligt psykotrop stof i store mængder, selv i moderate mængder i tilfælde af regelmæssigt forbrug (se alkoholisme ).
Andre alkoholer er generelt meget mere giftige, fordi:
- deres eliminering tager længere tid
- deres eliminering fører til nyreskader ;
- deres eliminering producerer giftige stoffer (for eksempel nedbryder leveren methanol til formaldehyd, der forårsager blindhed eller død).
Deres indtagelse betragtes som en medicinsk nødsituation.