Aceton
| Aceton | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Halvudviklet formel og 3D-repræsentation af acetone. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikation | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC navn | propan-2-one | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymer |
β-ketopropane |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.602 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EF | 200-662-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 180 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 3326 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILE |
CC (= O) C , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C3H6O / c1-3 (2) 4 / h1-2H3 InChIKey: CSCPPACGZOOCGX-UHFFFAOYAF Std. InChI: InChI = 1S / C3H6O / c1-3 (2) 4 / h1-2H3 Std. InChIKey: CSCPPACGZOOCGX-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Udseende | farveløs væske med en karakteristisk lugt. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formel |
C 3 H 6 O [Isomerer] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar masse | 58,0791 ± 0,0031 g / mol C 62,04%, H 10,41%, O 27,55%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolært øjeblik | 2,88 ± 0,03 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molekylær diameter | 0,482 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusion | −94,6 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kogning | 56,05 ° C ( 760 mmHg ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Opløselighed | blandbar med vand, ethanol , diethylether , estere , benzen , dimethylformamid , chloroform , de fleste olier | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Opløselighedsparameter δ |
20,3 MPa 1/2 ( 25 ° C ); 22,1 J 1/2 · cm -3/2 ( 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumenmasse |
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Automatisk tænding temperatur | 465 ° C eller 538 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flammepunkt |
−18 ° C (lukket skål), −9,4 ° C (åben skål) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eksplosionsgrænser i luft | 2,15 - 13 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
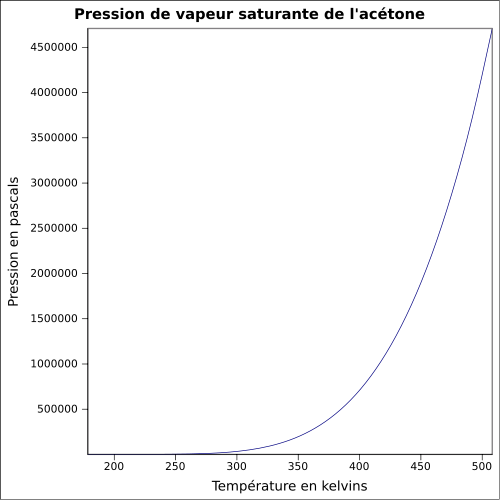
| Mættende damptryk |
228 mbar ved 20 ° C 360 mbar ved 30 ° C 814 mbar ved 50 ° C 1.385 mbar ved 65 ° C ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dynamisk viskositet | 0,32 cP ( 20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 235 ° C , 46,4 atm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | −94,5 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lydens hastighed | 1203 m · s -1 til 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokemi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 væske, 1 bar | 200,4 J · mol -1 · K- 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 fast | -249,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gas | -218,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 væske | -41 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ fus H ° | 5,7 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° | 31,3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
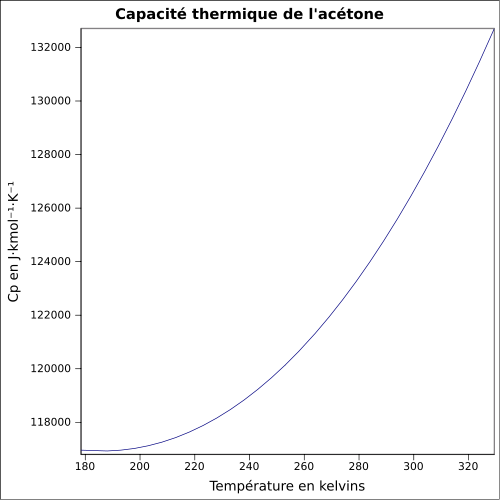
| C s |
125,5 J · mol -1 · K -1 (væske) 75 J · mol -1 · K -1 (gas) ligning:
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| STK | 1.789,9 kJ · mol -1 (flydende) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroniske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ioniseringsenergi | 9,703 ± 0,006 eV (gas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dielektrisk konstant | 21.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystallografi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalklasse eller rumgruppe | Pbcm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mesh-parametre |
a = 6,393 Å b = 5,342 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bind | 366,55 Å 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brydningsindeks | 1,3560 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forholdsregler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Fare H225, H319, H336, EUH066, P210, P233, P261, P280, P303 + P361 + P353, P370 + P378, H225 : Meget brandfarlig væske og damp H319 : Forårsager alvorlig øjenirritation H336 : Kan forårsage døsighed eller svimmelhed EUH066 : Gentagen eksponering kan medføre tør hud eller revner i huden P210 : Holdes væk fra varme / gnister / åben ild / varme overflader. - Rygning forbudt. P233 : Opbevar beholderen tæt lukket. P261 : Undgå indånding af støv / røg / gas / tåge / dampe / spray. P280 : Bær beskyttelseshandsker / beskyttelsestøj / øjenbeskyttelse / ansigtsbeskyttelse. P303 + P361 + P353 : Ved hud (eller hår): Fjern straks alt forurenet tøj. Skyl huden med vand / brusebad. P370 + P378 : I tilfælde af brand: Brug ... til udryddelse. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D2B, B2 : Brandfarligt flydende flammepunkt = -20 ° C lukket skål (metode ikke rapporteret) D2B : Giftigt materiale, der forårsager andre toksiske virkninger Øjenirritation hos dyr 1.0% offentliggørelse i henhold til ingrediensoplysningslisten |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 1 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transportere | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
33 : meget brandfarlig væske (flammepunkt under 21 ° C ) UN-nummer : 1090 : ACETONE Klasse: 3 Etiket: 3 : Brandfarlige væsker  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indånding | bronchial irritation, åndedrætsbesvær, beruselse, uklarhed | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Øjne | rødme, smerte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indtagelse | beruselse, besættelse | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Økotoksikologi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | > 5000 mg · kg -1 (oral), 20 g · kg -1 (kaninhud) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | -0,24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lugttærskel | lav: 3,6 ppm , 47,5 mg · m -3 ; top: 653 ppm , 1 613,9 mg · m -3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enheder af SI og STP, medmindre andet er angivet. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Den acetone (navneord) er kemi den forbindelsen enkleste af familien af ketoner . Af empiriske formel C 3 H 6 O, det er en isomer af propanal . Dens officielle navn IUPAC er propanon, men det er også kendt under navnene dimethylketon og beta-ketopropan .
Den Philae lander af Rosetta rumsonden har detekteret denne ti atom forbindelse på komet 67P / Tchourioumov-Guérassimenko , som vidner om tilstedeværelsen af dette molekyle i Solar System .
Fysisk-kemiske egenskaber
Aceton er en farveløs, brandfarlig væske med en karakteristisk ret frugtagtig lugt . Dets smeltepunkt er -94,6 ° C og kogepunktet af 56,05 ° C . Det har en vægtfylde på 0,783 og 0,819 ved 0 ° C . Det er en forbindelse, der er meget opløselig i vand (det er et polært molekyle med en kort kulstofholdig kæde ), i ethanol og i ether . Aceton er det enkleste derivat af den alifatiske ketonserie, og tilstedeværelsen af carbon-ilt- dobbeltbindingen giver det meste af dets reaktivitet. Det er et polært aprotisk opløsningsmiddel .
Acetone danner en hydrazon med phenylhydrazin og en oxim med hydroxylamin . En reduktion med amalgam af natrium omdanner det til isopropylalkohol ; oxidation med kromsyre giver kulilte og eddikesyre . Det reagerer med ammoniak til dannelse af di- og triacetonamin (en) (TAA). Det forenes også direkte med hydrogencyanid til dannelse af 2-hydroxy-2-methylsmørsyre- nitril . Denne cyanhydrin , som er det mellemprodukt, omdannes ved svovlsyre (H 2 SO 4) en sulfateret methacrylamidester, hvis hydrolyse giver ammoniumbisulfat og methacrylsyre .
Ved virkningen af forskellige reagenser, såsom kalk , kaustisk kali eller saltsyre , acetone er omregnet til kondensationsprodukter produkter , i mesityloxid C 6 H 10 OI phoron C 9 H 14 O, Etc.
Det omdannes til mesitylene C 9 H 12(symmetrisk trimethylbenzen) ved destillation i nærvær af svovlsyre. Aceton blev også brugt til fremstilling af farvning af kunstig indigo . I nærvær af jod , en base og vand giver det iodoform .
Aceton bruges også som kølemiddel , fordi blandingen med tøris (CO 2faste) fører ned til -78 ° C .
Produktion og syntese
Syntesen af acetonen er blevet beskrevet af Jean Béguin i 1610, fremstillet ved pyrolyse af blyacetat .
Aceton, der tidligere blev ekstraheret fra pyroligneøs syre som følge af pyrolysen af træ , var senere et biprodukt af eddikesyre .
I 1915 , Chaim Weizmann opdagede en billig måde at opnå acetone fra stivelse , der har lettet fremstillingen af Cordite , en eksplosiv .
I 2008 var den mest anvendte metode til fremstilling af acetone cumeneprocessen , som producerede den (såvel som phenol ) fra benzen og propylen . Den globale acetone-produktion er omkring 1,5 millioner ton om året.
brug
Aceton er et opløsningsmiddel, der er meget udbredt i industrien og i laboratoriet, fordi det har den fordel, at det opløses på en særlig hurtig måde adskillige organiske arter, og fordi det er blandbart med vand. Det er også en forbindelse ved fremstillingen af plast , medicin og andre produkter fra den syntetiske industri. Aceton anvendes især i industrien til at producere bisphenol A ved reaktion med phenol . Den bisphenol A er en vigtig bestanddel af mange polymerer såsom polycarbonat eller polyurethan samt epoxyharpikser . Aceton bruges også i stor skala til transport og opbevaring af acetylen : en beholder med et porøst materiale er fyldt med acetone, hvor acetylen derefter opløses (en liter acetone opløser ca. 250 liter acetylen).
Aceton er også hovedbestanddelen af nogle opløsningsmidler, der bruges til at fjerne neglelak . Det bruges også som opløsningsmiddel til opløsning af lim og cellulosefibre . Det anbefales ikke at bruge acetone på kunstige fibre (acetat, triacetat og akryl). Aceton bruges også til industriel affedtning.
Acetonebade bruges til fremstilling af kroppe under plastination .
Biologisk og mikrobiologisk aspekt
Aceton er en kropslig keton , der normalt findes i meget små mængder i urin og blod . Større mængder kan findes efter faste og hos diabetespatienter (hvis blodsukkerhåndtering er dårlig) med svær insulinmangel ; En frugtagtig lugt på ånde forårsaget af acetone er et af symptomerne på diabetisk ketoacidose .
Aceton forekommer naturligt i planter , træer , vulkanske gasser , skovbrande og som et nedbrydningsprodukt af animalsk fedt. Det findes i udstødningsgasser , tobak og lossepladser . Menneskelige aktiviteter producerer mere af det end naturen.
Det er en af de dannede produkter ved destruktiv destillation af træ , sukker , cellulose , etc. , og af denne grund er det altid til stede i ånden af rå træ, hvoraf en stor del kan genvindes ved fraktioneret destillation .
Sundheds- og sikkerhedseffekter
Kontakt med acetone kan forårsage irritation eller skade på huden . Stor og langvarig eksponering kan medføre bevidstløshed .
Undersøgelser af forsøgsdyr har vist skader på nyrer , lever og nerver såvel som fosteret ved langvarig eksponering for store doser acetone. Hannedyr udviste også reproduktionsforstyrrelser eller endda inhabiliteter. Det vides ikke, om denne slags effekter kan ses hos mennesker.
Ikke-toksiske millimolære doser acetone viser en krampestillende virkning i dyremodeller for epilepsi. Den grænseværdi for erhvervsmæssig eksponering (OELP) sættes til 500 ppm ( 1210 mg · m -3 ) i EU .
Indånding af acetone kan forårsage bronchial irritation, vejrtrækningsbesvær og indtagelse af acetone kan forårsage forgiftning og uklarhed .
Erhvervstoksikologi
Kilde.
Ved høje koncentrationer forårsager acetone centralnervesystemets depressive virkninger og irritation af slimhinderne. Gentagen eksponering af huden kan udløse kontaktdermatitis. På grund af farerne ved brand og eksplosion skal der træffes forebyggende og beskyttende foranstaltninger ved opbevaring og håndtering af acetone: valget af personlig beskyttelse foretages i henhold til forholdene på arbejdsstationen, de må ikke være en kilde til statisk elektricitet. Under de indledende og periodiske besøg vil den kliniske undersøgelse se efter tegn på neurologiske, okulære, kutane eller kroniske åndedrætsskader. Kvinder, der ønsker at blive gravide, udsættes så lidt som muligt på grund af frugtbarhedsrøde flag.
Noter og referencer
- ACETONE , sikkerhedsdatablad (er) fra det internationale program om sikkerhed for kemiske stoffer , hørt den 9. maj 2009.
- (en) " ACETONE " , om databank om farlige stoffer (adgang til 3. februar 2010 ) .
- (i) David R. Lide , Gummibibelen , Boca Raton, CRC Press / Taylor og Francis,17. juni 2008, 89 th ed. , 2736 s. ( ISBN 9781420066791 , online præsentation ) , s. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents , vol. 4, England, John Wiley & Sons,1999, 239 s. ( ISBN 0-471-98369-1 ).
- beregnet molekylmasse fra " Atomic vægte af elementerne 2007 " på www.chem.qmul.ac.uk .
- Acetone , INRS, toksikologisk ark FT3, 2008.
- (i) James E. Mark , Physical Properties of Polymer Handbook , Springer,2007, 2 nd ed. , 1076 s. ( ISBN 0-387-69002-6 , læs online ) , s. 294.
- (da) Robert H. Perry og Donald W. Green , Perrys kemiske ingeniørhåndbog , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50.
- (i) William M. Haynes , Gummibibelen , Boca Raton, CRC Press / Taylor og Francis,1 st juli 2010, 91 th ed. , 2610 s. ( ISBN 9781439820773 , online præsentation ) , s. 14-40.
- (i) Carl L. kæberne , Handbook of Termodynamiske diagrammer , Vol. 1, Huston, Texas, Gulf Pub. Co.,1996( ISBN 0-88415-857-8 ).
- (i) David R. Lide , Gummibibelen , Boca Raton, CRC Press,18. juni 2002, 83 th ed. , 2664 s. ( ISBN 0849304830 , online præsentation ) , s. 5-89.
- (i) David R. Lide , Gummibibelen , Boca Raton, CRC Press / Taylor og Francis,17. juni 2008, 89 th ed. , 2736 s. ( ISBN 9781420066791 , online præsentation ) , s. 10-205.
- “ Acetone ” , på www.reciprocalnet.org (adgang 12. december 2009 ) .
- Sikkerhedsdatablad leveret af Sigma-Aldrich, hørt om28. september 2019.
- " Acetone " i databasen over kemiske produkter Reptox fra CSST (Quebec-organisation med ansvar for sikkerhed og sundhed på arbejdspladsen), åbnet den 25. april 2009.
- (in) " Acetone " på hazmap.nlm.nih.gov (adgang 14. november 2009 ) .
- "acetone" , om ESIS (hørt om10. februar 2009).
- (i) Fred Goesmann Helmut Rosenbauer, Jan Hendrik BREDEHöFT Michel Hut, Pascale Ehrenfreund Thomas Gautier, Chaitanya Giri, Harald Krüger, Lena Roy, Alexandra J. MacDermott, Susan McKenna-Lawlor, Uwe J. Meierhenrich Guillermo M Muñoz Caro, Francois Raulin , Reinhard Roll, Andrew Steele, Harald Steininger, Robert Sternberg, Cyril Szopa, Wolfram Thiemann og Stephan Ulamec, " Organiske forbindelser på komet 67P / Churyumov-Gerasimenko afsløret af COSAC massespektrometri " , Science , bind. 349, nr . 6247,31. juli 2015( DOI 10.1126 / science.aab0689 , læs online ).
- Jean Béguin, overs. Jean Lucas Du Roi, Les elemens de chymie, de maistre Iean Beguin almosnier du Roy , hos Mathieu Le Maistre, ruë sainct Iean de Laterran à l'Arbre sec,1620( læs online ).
- Likhodii et al. , 2003.
- INRS FT3 toksikologisk ark ,oktober 2018.
Se også
eksterne links
- International sikkerhedskort , på cdc.gov .
- (da) Aceton , på webbook.nist.gov .
- (en) Farlig kemisk database på ull.chemistry.uakron.edu .