Chloraceton
| Chloraceton | |||
 | |||
| Identifikation | |||
|---|---|---|---|
| Systematisk navn | chloropropanon | ||
| Synonymer |
acetonylchlorid, 1-chlor-2-propanon, monochloracetone, 1-chlor-2-ketopropan, 1-chlor-2-oxypropan |
||
| N o CAS | |||
| N o ECHA | 100.001.056 | ||
| PubChem | 6571 | ||
| SMILE |
ClCC (= O) C , |
||
| InChI |
Std. InChI: InChI = 1S / C3H5ClO / c1-3 (5) 2-4 / h2H2,1H3 Std. InChIKey: BULLHNJGPPOUOX-UHFFFAOYSA-N |
||
| Udseende | lyserød væske med en skarp lugt | ||
| Kemiske egenskaber | |||
| Brute formel |
C 3 H 5 Cl O [isomerer] |
||
| Molar masse | 92,524 ± 0,005 g / mol C 38,94%, H 5,45%, Cl 38,32%, O 17,29%, |
||
| Fysiske egenskaber | |||
| T ° fusion | −44 ° C | ||
| T ° kogning | 119 ° C | ||
| Opløselighed | 100 g · L -1 (vand ( 20 ° C ) | ||
| Volumenmasse | 1,15 g · cm -3 ( 20 ° C ) | ||
| Dampmassefylde | 3.19 | ||
| Dampmassefylde af blandingen med luft | 1,09 | ||
| Automatisk tænding temperatur |
610 ° C klasse T1 |
||
| Flammepunkt | 35 ° C | ||
| Eksplosionsgrænser i luft | 3,4 volumenprocent - | ||
| Mættende damptryk |
8 hPa ( 20 ° C ) 105 hPa ( 50 ° C ) 185 hPa ( 65 ° C ) |
||
| Dynamisk viskositet | 1,11 mPa · s ( 25 ° C ) | ||
| Forholdsregler | |||
| SGH | |||
   H226, H301, H310, H315, H319, H330, H335, H410, P210, P273, P280, P302 + P352, P304 + P340, P305 + P351 + P338, P308 + P310,
H226 : Brandfarlig væske og damp
H226, H301, H310, H315, H319, H330, H335, H410, P210, P273, P280, P302 + P352, P304 + P340, P305 + P351 + P338, P308 + P310,
H226 : Brandfarlig væske og damp H301 : Giftig ved indtagelse H310 : Dødelig ved hudkontakt H315 : Forårsager hudirritation H319 : Forårsager alvorlig øjenirritation H330 : Dødelig ved indånding H335 : Kan irritere luftvejene H410 : Meget giftig for vandlevende organismer, med langvarig effekter P210 : Holdes væk fra varme / gnister / åben ild / varme overflader. - Rygning forbudt. P273 : Undgå udledning til miljøet. P280 : Bær beskyttelseshandsker / beskyttelsestøj / øjenbeskyttelse / ansigtsbeskyttelse. P302 + P352 : I tilfælde af hudkontakt: vask med rigeligt sæbe og vand. P304 + P340 : Efter indånding: Flyt offeret ud i frisk luft og hold det i ro i en behagelig vejrtrækningsposition. P305 + P351 + P338 : Ved øjnene: Skyl forsigtigt med vand i flere minutter. Fjern kontaktlinser, hvis offeret har dem på, og de let kan fjernes. Fortsæt med at skylle. P308 + P310 : I tilfælde af bevist eller mistanke om eksponering: ring til et GIFTINFORMATION eller en læge. |
|||
| Transportere | |||
663 : meget giftigt og brændbart materiale (flammepunkt lig med eller mindre end 60 ° C ) UN-nummer : 1695 : stabiliseret CHLORACETONE Klasse: 6.1 Etiketter: 6.1 : Giftige stoffer 3 : Brandfarlige væsker 8 : Ætsende stoffer Emballage: Gruppe emballage I : meget farlige materialer;    |
|||
| Økotoksikologi | |||
| DL 50 |
100 µl · kg -1 (marsvinhud) 127 mg · kg -1 (mus, oral ) 141 mg · kg -1 (kanin, dermal) 80 mg · kg -1 (rotte, ip ))> 100 mg · kg -1 (rotte, oral)) |
||
| CL 50 | 262 ppm / 1 H (rotte, indånding) | ||
| Enheder af SI og STP, medmindre andet er angivet. | |||
Den chloracetone eller chloracetone er en organisk forbindelse chloreret derivat af acetone , med formlen C 3 H 5 ClO.
Ejendomme
Chloracetone kommer i form af en klar lyserød væske med en skarp lugt. Det er en brandfarlig væske, der kan danne eksplosive blandinger med luft over sit flammepunkt ( 35 ° C ). Det er opløseligt i vand (100 g / l) og har medium til lav flygtighed . Det udgør akutte eller kroniske sundhedsrisici og er farligt for vandlevende organismer.
Chloracetone nedbrydes ved opvarmning og producerer blandt andet hydrogenchlorid , acetone og aldehyder. Det reagerer farligt med oxidationsmidler og baser . Ved opbevaring i lang tid polymeriserer chloraceton kraftigt eller endda eksplosivt. En prøve opbevaret på denne måde i to år eksploderede kort efter at være blevet ramt. Af denne grund sælges det generelt i "stabiliseret" form, for eksempel som en blanding med 0,5% calciumcarbonat .
Historie
Under første verdenskrig blev chloraceton brugt af Frankrig som en tåregasgenerator , først i november 1914 under navnet "Tonite", derefter blandet med brom under navnet "Martonite".
Produktion
Chloracetone produceres ved chlorering af acetone , fx ved at indføre chlorgas i en suspension af calciumcarbonat i acetone. Hvis klorering er for stærk, produceres der også andre forbindelser, di- eller trichloracetoner. Disse er meget mere giftige, men mindre irriterende end (mono-) chloracetone. Biprodukterne kan derefter adskilles ved destillation , men operationen kan være vanskelig på grund af nærheden af deres respektive kogepunkter.
Chloracetone kan også syntetiseres ved reaktion mellem chlor og diketen .
Utilsigtet produktion
I laboratoriet kan chloracetone ved et uheld produceres og frigives i kloreringsreaktioner, hvis acetone bruges som opløsningsmiddel , eller hvis acetone bruges til at rense materiale, der er forurenet med et kloreringsmiddel eller klor selv. (I opløst form). Kontakt forårsager betydelig irritation eller endda alvorlige forbrændinger i øjne og hud, og luftvejene kan også blive påvirket. Ved fremstilling af acetone peroxid med saltsyre som katalysator kan der dannes chloracetone, hvis reaktionsblandingen bliver for varm.
Oprensning
Kommerciel chloracetone indeholder 5% urenheder, især mesityloxid, som ikke kan fjernes ved destillation. Mesityloxid kan oxideres under anvendelse af KMnO 4 i et surt medium til dannelse af en diol (efterfulgt af separation med ether), der derefter kan fjernes ved destillation.
Ansøgninger
Chloracetone bruges til at fremstille farvestofkoblinger (in) i farvefotografering og er et syntesemellemprodukt. Chloracetone kan også bruges i syntesen af Feist-Benary (in) af furan :
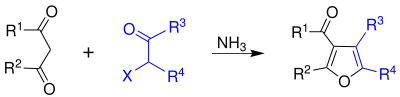
Omsætning af phenolat med chloracetone giver phenoxyacetone, som derefter bruges til at fremstille mange farmaceutiske forbindelser. En katalytisk mængde kaliumiodid er også nødvendig for at lette en Finkelstein-reaktion .
Noter og referencer
- (en) / (de) Denne artikel er helt eller delvist taget fra artiklerne titlen i engelsk " Chloroaceton " ( se listen over forfattere ) og i tysk " Chloraceton " ( se listen over forfattere ) .
- Indtastning "78-95-5" i den kemiske database GESTIS fra IFA (tysk organ med ansvar for arbejdsmiljø) ( tysk , engelsk ), adgang til 13. april 2020 (JavaScript krævet) .
- beregnet molekylmasse fra " Atomic vægte af elementerne 2007 " på www.chem.qmul.ac.uk .
- Kodak Company Rapporter. Flyvningen. 21. maj 1971
- Sargent EV, Kirk GD, Hite M., “ Hazard evaluering of monochloroacetone ”, American Industrial Hygiene Association Journal , vol. 47,Juli 1986( PMID 3751887 )
- Oyo Yakuri. Farmakometri. Flyvningen. 33, s. 695, 1987.
- Fys. Chem. Chem. Phys., 2000,2, 237-245
- Gloria J. Hathaway og Nick H. Proctor , Proctor og Hughes 'kemiske farer ved arbejdspladsen , Wiley-Interscience, 2004, 143–144 s. ( ISBN 978-0-471-26883-3 , læs online )
- Jie-Jack Li og EJ Corey , navne reaktioner i heterocyklisk kemi , Wiley-Interscience, 2004, 160 s. ( ISBN 978-0-471-30215-5 , læs online )
- Charles D. Hurd og Percy Perletz , " Aryloxyacetones1 ", Journal of the American Chemical Society , bind. 68, nr . 1,1946, s. 38–40 ( ISSN 0002-7863 , DOI 10.1021 / ja01205a012 )
Se også
- WWI Combat Gas
- Bromacetone
- Fluoracetone
- 1,3-dichloracetone
- Hexachloracetone